搜索


近日,分子生物学知名刊物《Nucleic Acids Research》和微生物学经典刊物《Molecular Microbiology》先后发表了6165cc金沙总站、微生物代谢国家重点实验室邓子新团队欧竑宇研究组关于细菌毒素-抗毒素系统的生物信息学和实验研究的两篇论文,进一步阐明肺炎克雷伯菌中耐药基因水平转移和持留态细胞形成的分子机制。
由于抗菌药物的不合理使用,细菌耐药性急速加剧。碳青霉烯类药物抗性在肺炎克雷伯菌等革兰阴性条件致病菌中的快速播散,更是成为全球面临的最严重公共卫生问题之一。质粒、整合性接合元件、转座子等可移动遗传元件是介导耐药和致病基因水平转移的主要载体。细菌的毒素-抗毒素系统 (toxin-antitoxin sytem, TA) 与这些移动元件的遗传稳定性密切相关,是影响耐药性扩散的重要因素。TA系统由稳定的毒素蛋白和不稳定的抗毒素蛋白(或RNA)组成,它们是由一个操纵子中两个结构基因编码的。毒素蛋白对细菌生长具有致死或抑制作用,而抗毒素蛋白能中和毒素的毒性。
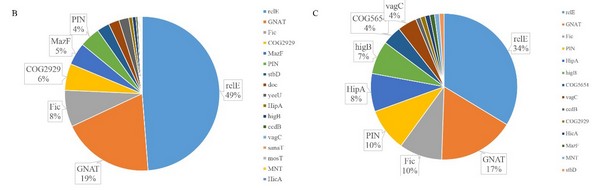
欧竑宇研究组通过文本实体识别和语义提取,广泛地收集了散布于文献和公共数据库的异质数据,梳理了一百多对经实验验证的和近六千对潜在的TA系统,定义和审编了基因座位、操纵子结构、家族归类、毒素作用靶位点、宿主菌和实验文献等等基本数据项,更新了基于web的开放数据库TADB。此外,采用隐马尔可夫模型搜索保守域和操纵子结构识别相结合的算法,开发了在线工具TAfinder用于预测II 型TA系统。TAfinder对两千多个细菌的全基因组序列进行扫描后,发现了乙酰基转移酶类RHH-GNAT家族的TA系统广泛分布于肠道沙门菌和肺炎克雷伯菌的染色体上,仅次于目前研究的最深入的RelBE家族。相关研究论文“TADB 2.0: an updated database of bacterial type II toxin-antitoxin loci”发表在《Nucleic Acids Research》上,谢英洲、卫以青和申阅同学为共同第一作者,欧竑宇教授为通讯作者。
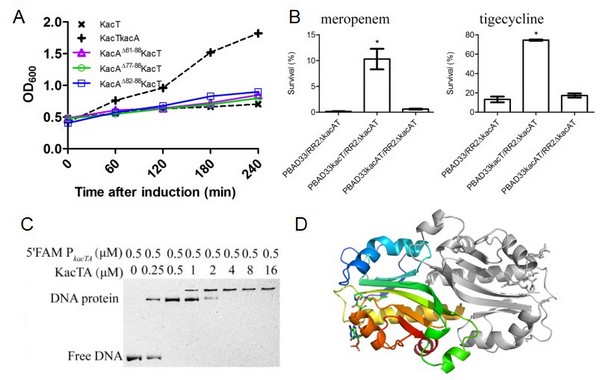
欧竑宇研究组进而以在碳青霉烯类耐药肺炎克雷伯菌HS11286中预测到的乙酰基转移酶类RHH-GNAT TA系统KacAT为研究模型,开展实验验证工作。近期,在肠道沙门菌和致病大肠杆菌中已分别报道了GNAT毒素蛋白通过乙酰化tRNA携带的氨基酸以阻遏蛋白质的正常翻译;但RHH抗毒素蛋白中和GNAT毒素毒性的分子机制还未阐明。研究人员和复旦大学生命科学学院甘建华教授研究组开展合作,解析了GNAT毒素蛋白KacT晶体结构,发现KacT以二聚体形式发挥乙酰基转移酶的功能。生理和生化实验表明,RHH抗毒素蛋白KacA在胞内和毒素KacT共表达时,形成KacA4KacT2异源六聚体复合物以抑制毒素形成功能性的二聚体。此外,KacAT复合物特异地结合到kacAT操纵子的启动子区,在转录水平实现KacAT操纵子的反馈抑制。抗毒素KacA的C-端结合毒素蛋白KacT;而N-端结合DNA。在高浓度碳青霉烯等抗菌药物压力下,GNAT毒素蛋白KacT的过表达促进肺炎克雷伯菌形成持留态细胞,提高病原细菌对抗菌药物的耐受性。相关工作入选了2017年全国环境微生物学学术研讨会的大会报告;研究论文“Identification and characterization of acetyltransferase-type toxin-antitoxin loci inKlebsiella pneumoniae”发表在《Molecular Microbiology》上,钱宏亮同学为第一作者,欧竑宇教授和复旦大学生命科学学院甘建华教授为共同通讯作者。
邓子新团队的欧竑宇研究组长期从事耐药病原细菌的可移动基因组研究。以上两篇论文是继该研究组发现了碳青霉烯酶基因blaKPC-2借助Tn1721-Tn3复合转座子在ST11型肺炎克雷伯菌中扩散(Journal of Antimicrobial Chemotherapy,2015)、亚抑制浓度β-内酰胺药物增强肺炎克雷伯菌六型分泌系统的菌间拮抗作用(Frontiers in Cellular and Infection Microbiology,2017)、携带第三代头孢菌素抗性基因blaDHA-1的耐药质粒可在肺炎克雷伯ST23型高毒株中接合转移(Virulence,2018)以来,在肺炎克雷伯菌耐药性扩散的研究上的系统性进展。研究工作获得了国家自然科学基金和973项目的资助。


 首页
首页

 学院概况
学院概况

 师资队伍
师资队伍

 人才培养
人才培养

 招生就业
招生就业

 科学研究
科学研究

 平台基地
平台基地

 党群工作
党群工作

 校友之家
校友之家

 安全工作
安全工作

 网上办事
网上办事

 当前位置:
当前位置: